一、教材页展示



一、教学目标
1.以氯化钠晶体的形成为例,认识离子键的形成过程,建立“离子键”的概念,并且能够用电子式对离子键进行表征。
2.通过小组讨论氯化钠的形成过程,从原子结构的角度认识离子键的形成过程,建立“离子键”的理论模型,并且能够用该模型解释和预测物质的组成、结构、性质及变化。
3.通过构建化学键、离子键的化学概念,感受微粒之间的相互作用,在探究过程中提升严谨求实的科学态度。
二、教学重难点
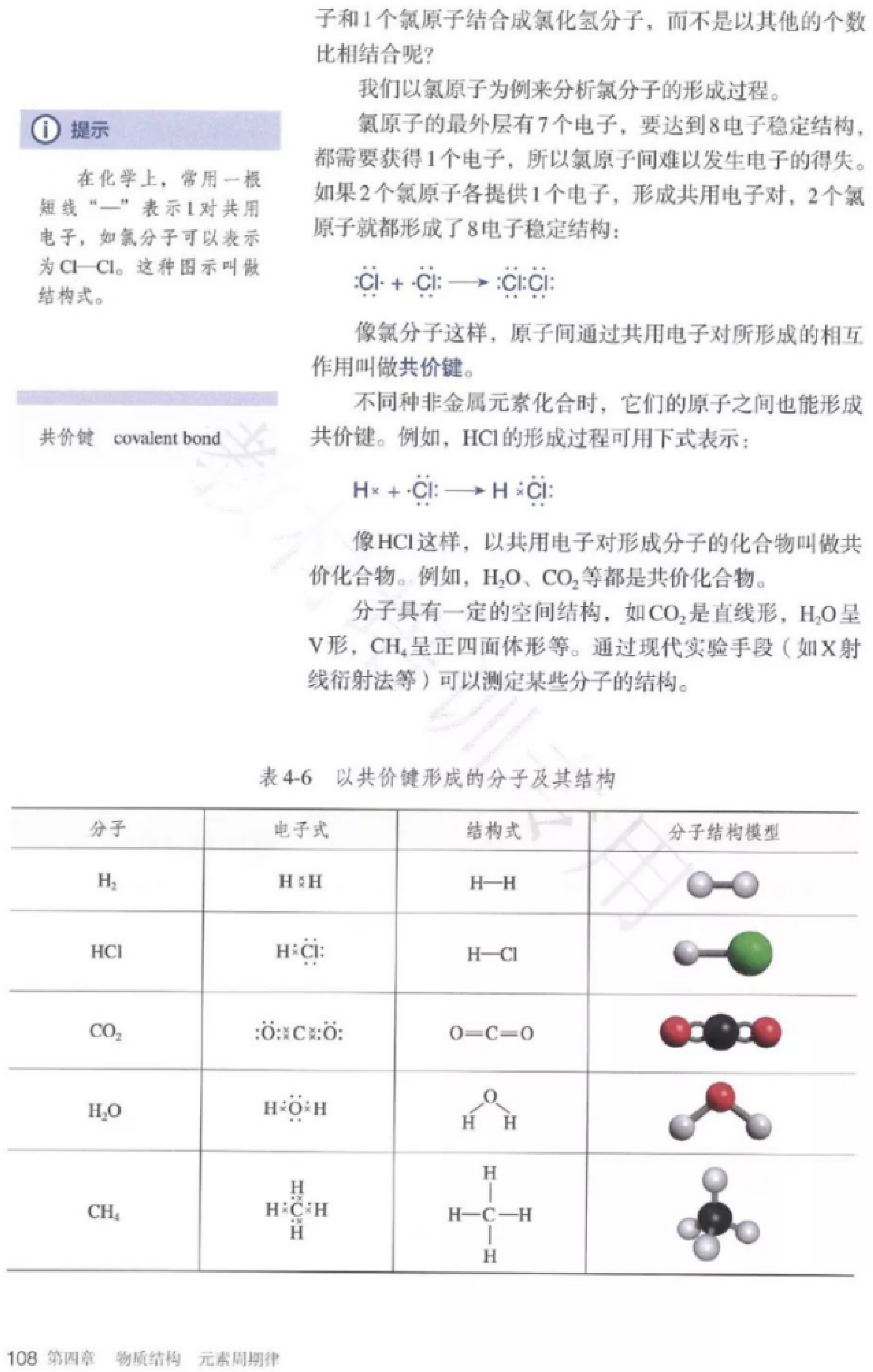
【重点】离子键、离子化合物、共价化合物的概念;电子式的书写。
【难点】电子式的书写。
三、教学方法
讲授法、谈话法、小组讨论法。
四、教学过程
(一)复习导入
提出问题:从元素周期表可以看出,目前为止,已经发现的元素有一百多种。然而,由这一百多种元素的原子构成的物质已经超过一亿种。那么,元素的原子之间通过什么作用形成如此丰富的物质呢?
导入新课。
(二)新知探究
1.建构“化学键”的概念
引导:NaCl固体不导电,加热至熔融后导电。
提问:
①NaCl在不同情况下的导电性差异的事实说明什么?(从微观视角回答、思考)
②由钠离子、氯离子构成的氯化钠在熔融态时能电离出离子,为什么在固态的时候不能电离出离子呢?(从微粒间的相互作用思考氯化钠在不同条件下导电的差异性。)
引导:常温下HCl气体不导电,溶于水后导电,降温后转化为液态HCl不导电。
提问:HCl在不同情况下的导电性差异说明了什么?
教师总结:上述事实说明构成物质的微粒之间存在着强烈的相会作用。我们把相邻原子之间强烈的相互作用叫做化学键。
2.离子键的形成
展示:氯气与金属钠反应的实验视频。
学生活动:记录实验现象,写出化学方程式。
学生讨论:①氯化钠中的微粒是什么?从微粒组合的角度看,上述反应的过程和结果如何?②画出钠原子、氯原子的结构示意图,分析它们是否稳定。如果不稳定,它们们怎样才能形成稳定结构?③用示意图的方式表示氯化钠的形成过程。④思考氯化钠中Na+、Cl-是如何结合在一起的?
教师总结:带相反电荷原子之间离子的相互作用叫离子键。
教师讲授:阐述电子式的涵义,展示用电子式表示NaCl的形成过程的化学用语。给出离子化合物的概念。
![]()













