一、教材页展示


图片选自人教版九年级上册第六单元课题2
一、教学目标
1.能够通过对比氧气、二氧化碳的性质和制取原理确定实验室制取二氧化碳气体的气体发生装置和收集装置,并由此总结出实验室制取气体的一般思路,初步建立气体制备的思维模型。
2.通过探究实验室制取二氧化碳气体的发生和收集装置,逐步学会用比较和归纳的方法解决问题。
3.逐步养成勤于思考、乐于实践、善于合作的科学品质。
二、教学重难点
【重点】实验室制取二氧化碳的原理、装置设计及制取方法。
【难点】实验室制取气体装置的探究过程。
三、教学方法
讲授法、谈话法、小组讨论法。
四、教学过程
(一)情境导入
情境:小学的时候曾经做过一个实验,把带壳的鸡蛋浸泡在白醋中,过一段时间,会在鸡蛋壳表面看到很多小气泡,慢慢的鸡蛋壳也溶解了。
提问:在这一过程中发生了什么变化?鸡蛋壳的主要成分是什么?
引导:实验室也利用类似的实验原理来制取二氧化碳气体。实验室常用稀盐酸和大理石反应来制取。化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑。那么根据所选的药品和反应原理,实验室该如何选取二氧化碳制取装置?引入新课。
(二)新知探究
1.提问:实验室里制取气体的装置包括哪些部分?选择气体发生装置和收集装置分别考虑的因素有哪些?实验室使用的气体收集装置有哪几种?(小组讨论)
总结:①实验室里制取气体的装置包括气体发生装置和收集装置两部分。②选择气体发生装置需要考虑反应物的状态和反应条件。③实验室选择气体收集装置需要考虑气体的密度,水溶性,是否与水反应,可以采用的收集气体的方法有排水集气法、向上排空气法、向下排空气法。
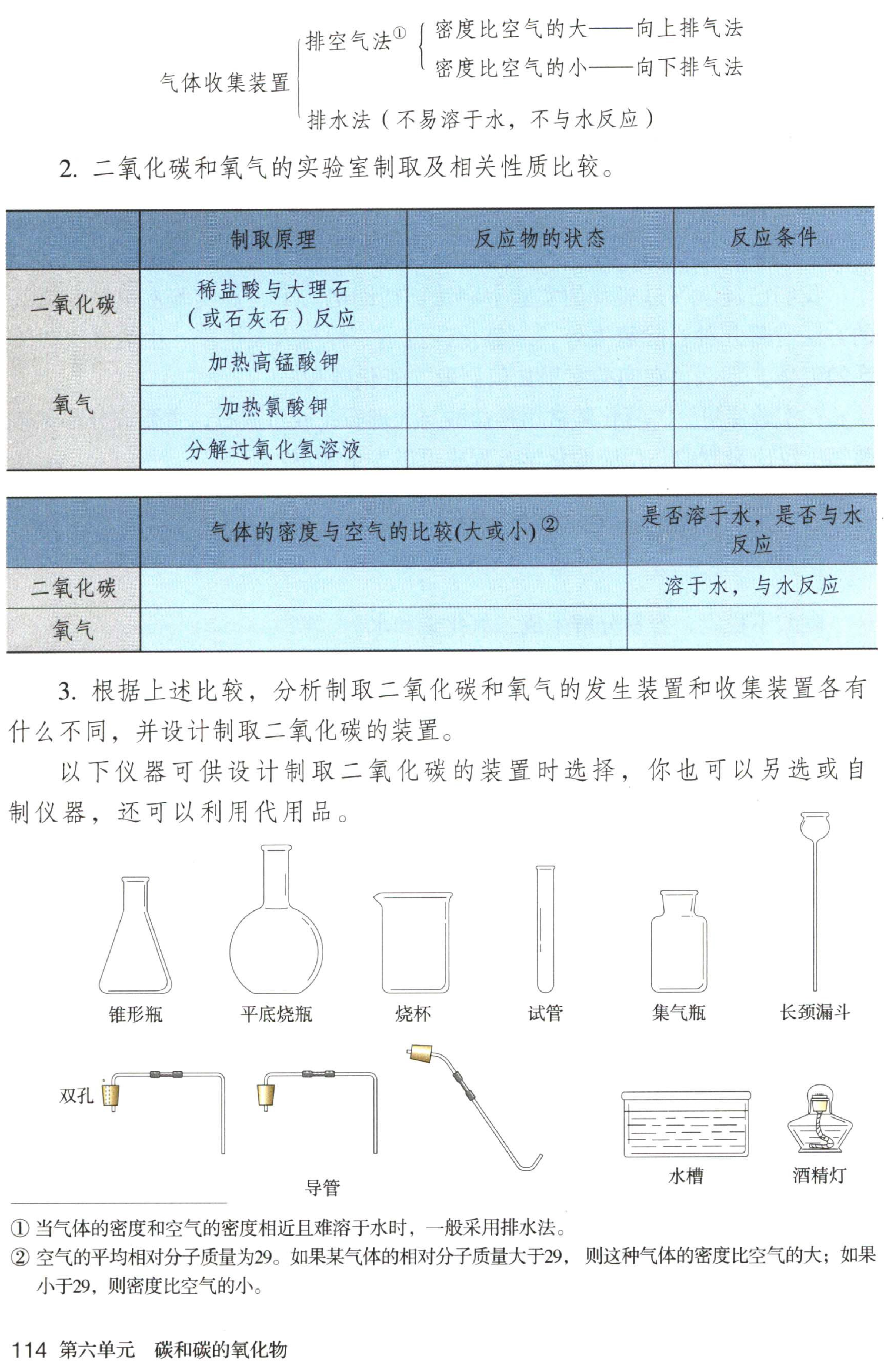
2.学生活动:对比二氧化碳和氧气的实验室制取方法及相关性质进行比较并且填表。
表1 二氧化碳和氧气的实验室制取方法
| ? ? | 制取原理 | 反应物的状态 | 反应条件 |
| 二氧化碳 | 稀盐酸与大理石 | 液体+固体 | 常温 |
| ? ? 氧气 ?? | 加热高锰酸钾 | 固体 | 加热 |
| 加热氯酸钾 | 固体+固体 | 加热,二氧化锰做催化剂 | |
| 分解双氧水 | 液体+固体 | 常温,二氧化锰做催化剂 |
表2 ?二氧化碳和氧气的相关性质
| ? ? | 气体密度与空气的比较 | 是否溶于水,是否与水反应 |
| 二氧化碳 | 相同条件下,二氧化碳的密度比空气大 | 溶于水,与水反应 |
| 氧气 | 相同条件下,氧气的密度比空气略大 | 不易溶于水,不与水反应 |
3.提问:根据比较得到的结果,分析制取二氧化碳和氧气的发生装置和收集装置各有什么不同?实验室制取二氧化碳与收集二氧化碳的装置应该是怎样的?
总结:实验室制取二氧化碳的气体发生装置与分解过氧化氢制取氧气的装置相同;收集方法应该采用向上排空气法。
4.小组活动:结合老师提供的实验装置设计制取二氧化碳的装置,画图表示出来。小组之间探讨比较优缺点,选择一套认为最佳的装置。
总结展示:利用多媒体展示的实验器材设计一套实验室制取二氧化碳气体的发生与收集装置,分析这套装置的优势:①选择长颈漏斗,可以通过加入液体药品控制反应的发生与停止;②长导管接近集气瓶底部,更有助于排净空气。

提示:实验时所加液体应没过长颈漏斗下端管口,避免产生的气体沿着长颈漏斗逸出到瓶外。
5.提问:怎样检验生成的气体是二氧化碳?用集气瓶收集二氧化碳时,怎样证明集气瓶中已充满了二氧化碳?
总结:结合二氧化碳的性质。①检验生成的气体是二氧化碳:把气体通入澄清石灰水中,如果变浑浊,说明是二氧化碳气体;②检验二氧化碳收集满了:用燃着的木条靠近集气瓶口,如果木条熄灭,说明收集满了。
6.学生活动:结合二氧化碳和氧气的实验室制取的探究,总结实验室制取气体的一般思路和方法。
总结:①选择适当的反应,包括反应物和反应条件;②选择合适的实验装置;③验证所制得的气体。
(三)巩固提升
学生活动:列举你所知道的能生成二氧化碳的反应,能用化学方程式表示的,写出化学方程式。然后与同学讨论这些反应能否用于在实验室里制取二氧化碳,并说明理由。
(四)课堂小结
请学生回答本堂课的收获:二氧化碳的制取装置和收集装置的选取。
(五)作业布置
课下以学习小组为单位,查阅资料,总结二氧化碳的性质及其用途。
五、板书设计













