一、教材页展示


图片选自人教版《必修一》第四章第二节
一、教学目标
1.能结合有关数据和实验事实认识原子结构、元素性质呈周期性变化的规律,建构元素周期律。以第三周期的钠、镁、铝、硅、硫、氯,以及碱金属和卤族元素为例,了解同周期和主族元素性质的递变规律。
2.通过元素周期律的学习,认识元素“位”“构”“性”之间的内在联系,能根据元素“位”“构”的特点预测和解释元素的性质;
3.能利用元素在元素周期表中的位置和原子结构,分析、预测、比较元素及其化合物的性质。
4.能结合有关资料说明元素周期律(表)对合成新物质、制造新材料的指导作用。体会元素周期律在科学研究中的重要作用。
二、教学重难点
【重点】
1.掌握元素周期律涵义和实质,元素性质与原子结构的关系。
2.学会用图表等方法分析、处理数据,对数据和事实进行总结、概括从而得出结论。
【难点】
1.元素周期律涵义和实质,元素性质与原子结构的关系。
2.利用元素周期律预测、比较元素及其化合物的性质。
三、教学方法
讲授法、谈话法、小组讨论法、实验法。
四、教学过程
(一)复习导入
提问:碱金属元素、卤素的原子结构和性质是怎样的?
总结:元素周期表中同主族元素的性质有着相似性和递变性。
提问:周期表中同周期元素的性质有什么变化规律?
导入新课。
(二)新知探究
1.初探元素周期律
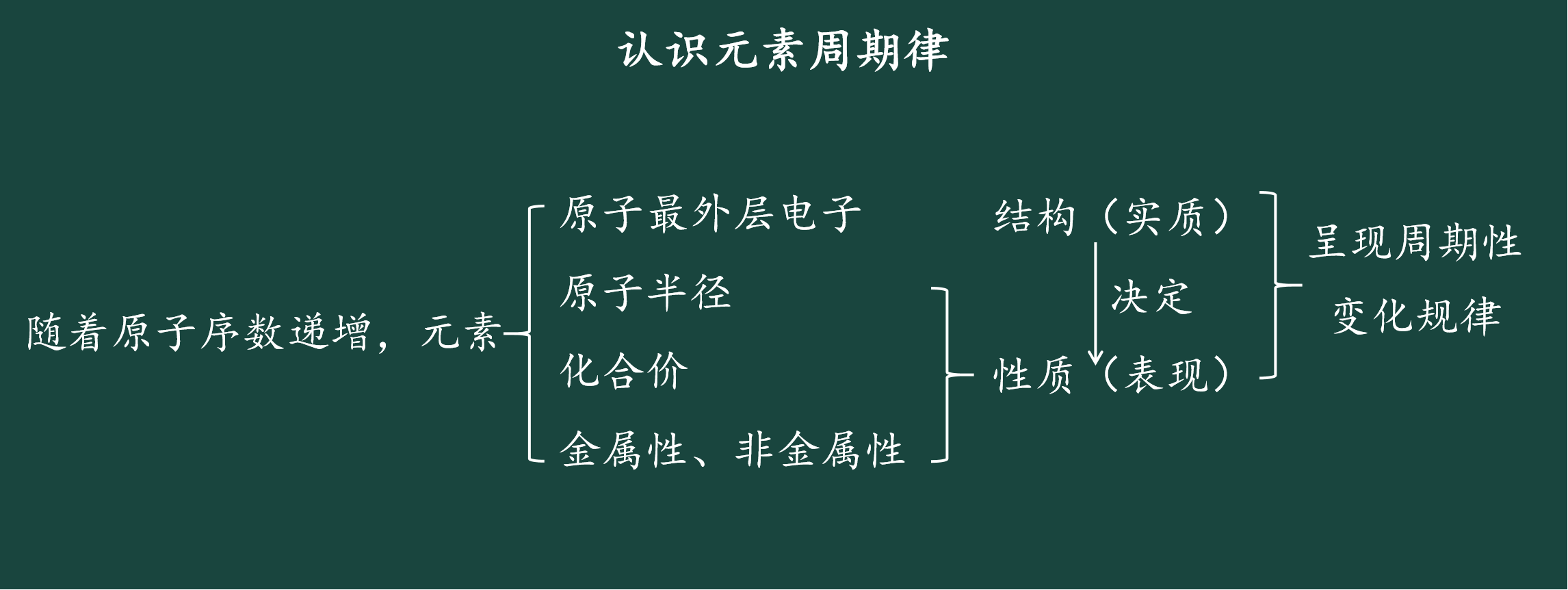
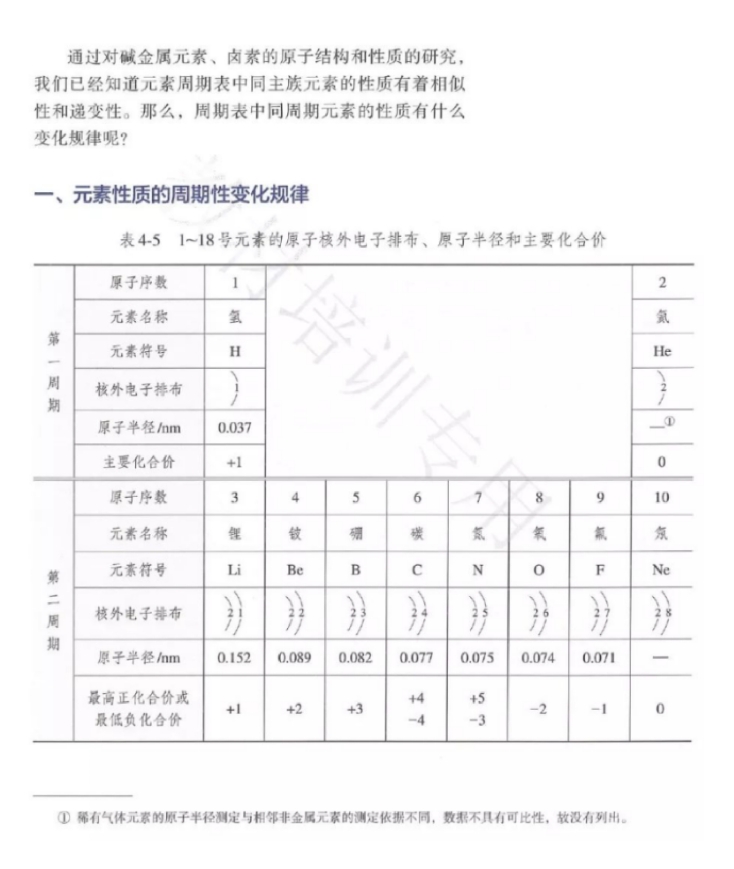
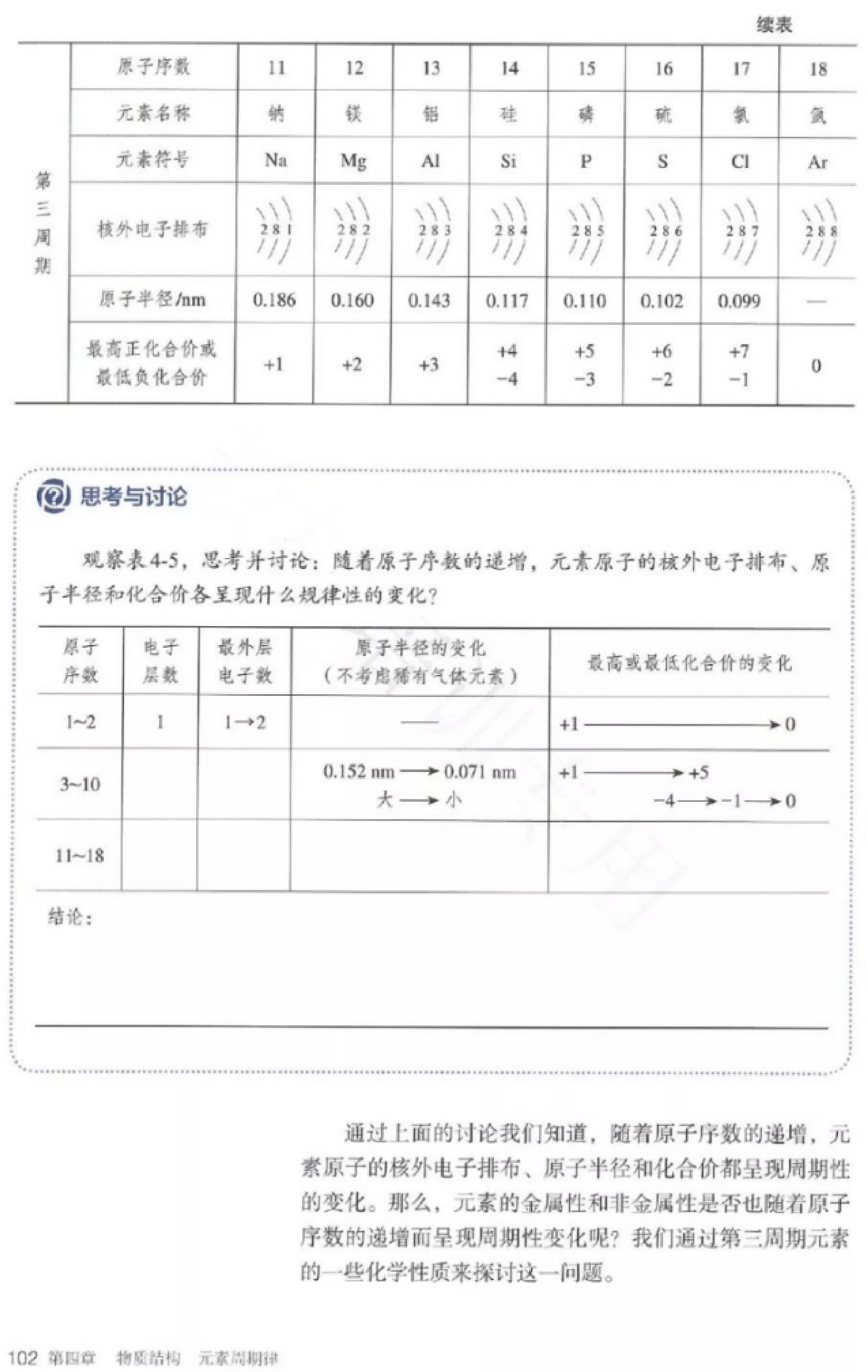
任务布置:以教材101页,表4-5为依据,用坐标格子描点划线的形式得出的最外层电子数、原子半径、化合价随原子序数递增的变化规律。
学生活动:展示图示,并回答,得出电子层数、最外层电子数、原子半径、最高或最低化合价的变化随着原子序数递增出现周期性变化规律。
2.再探元素周期律
提问:元素的化学性质(金属性、非金属性)呈现出怎样的规律?
提示:
元素金属性强弱判断依据:①单质还原性强弱(与水或酸反应置换出氢气的难易程度);②最高价氧化物水化物的碱性强弱。
元素非金属性强弱判断依据:①单质与H2反应的难易和生成氢化物的稳定性;②最高价氧化物水化物的酸性。
学生活动:以11-17号元素为例探究元素的金属性和非金属性的变化规律。
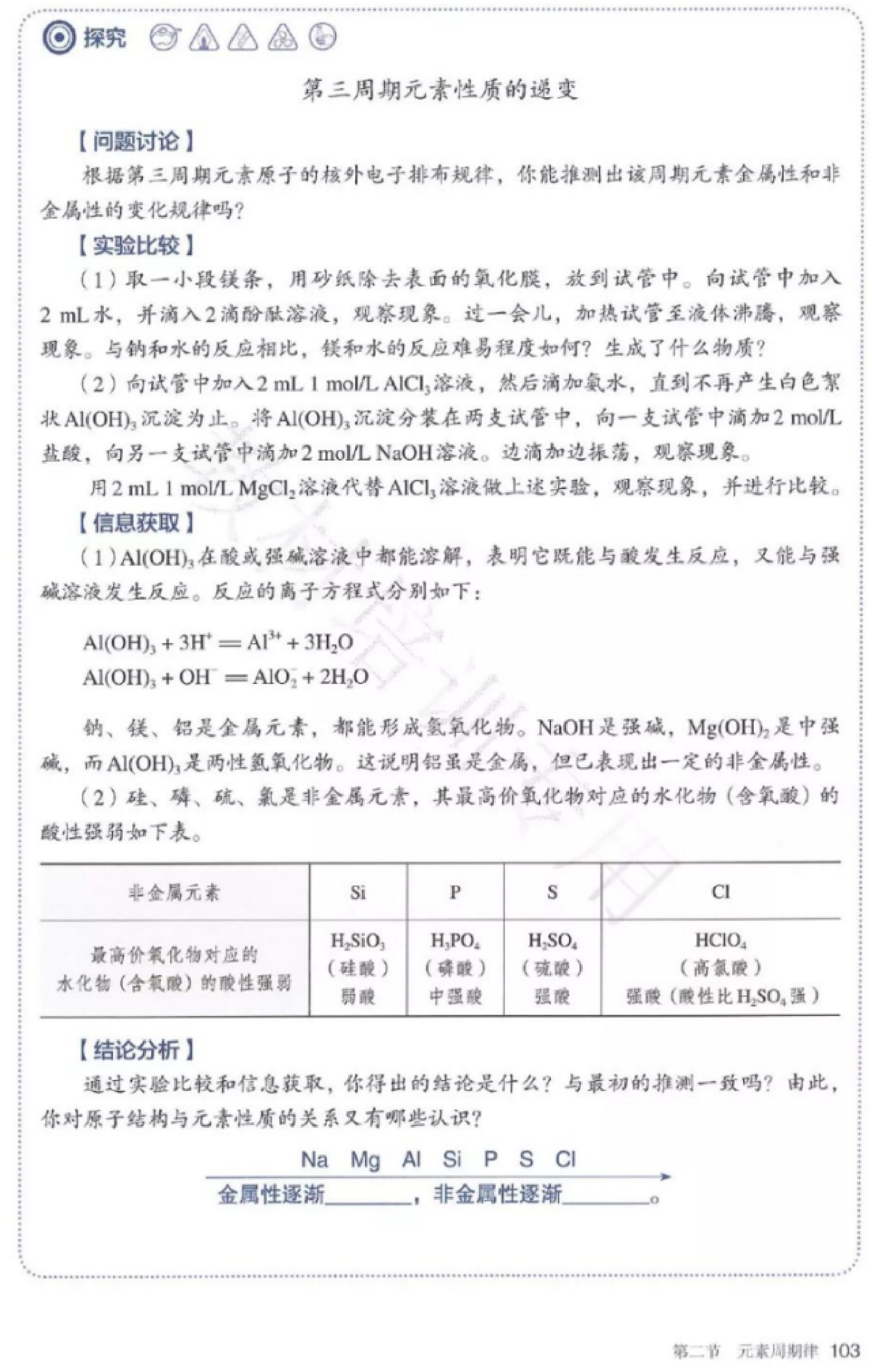
(1)实验探究金属性变化规律
a.实验前预测11~17号元素的金属性和非金属性如何变化?
b.结合所提供的药品:镁条、铝片、稀盐酸、蒸馏水、MgCl2、AlCl3、NaOH、酚酞;仪器:小试管、砂纸设计实验验证对Na、Mg、Al三种金属金属性的判断。
c.实验后反思评价,交流,得出金属性、变化规律。
(2)阅读探究非金属性变化规律
a.阅读教材103页硅、硫、氯元素单质化合物的资料信息,以小组为单位,从信息资料中抽提出有用信息,对比出硅、磷、硫、氯的非金属性强弱。
b.将金属与非金属联合起来,总结出第三周期元素金属性、非金属性变化的结规律。
3.元素周期律的本质
提问:为什么元素的金属性、非金属性会呈现一定的变化规律?对其他周期的主族元素进行同样的研究,是不是会得出类似的规律?
总结:元素的金属性、非金属性随着原子序数的递增而呈现周期性的变化。元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
(三)拓展提升
1.元素周期律的应用
教师引导:介绍农药、半导体材料、催化剂、特种合金材料等的选择的周期表周期律具体应用。
2.结合卤族元素的性质,预测砹元素的性质,包括单质的颜色、状态,砹化银的溶解性等。
(四)课堂小结
学生总结本节课的收获,教师进行点拨,评价学生本节课的表现。
(五)作业布置
作业:①课后习题;②课下查阅资料,了解门捷列夫预言了哪些新元素,这些元素是如何被确认的,撰写研究报告,与学习小组的同学进行交流。
五、板书设计